Novas fronteiras no cerco ao câncer
Antigamente, receber o diagnóstico de câncer era quase como ouvir uma sentença de morte. Até hoje a palavra assusta, é verdade. Mas o cenário do tratamento mudou radicalmente, na esteira de um avanço profundo no conhecimento dos tumores e de como nosso sistema imune é mobilizado (e às vezes enganado) na hora de enfrentá-los.
Hoje, boa parte dos oncologistas tem uma história parecida com esta: acompanha há alguns anos um paciente com um tipo de câncer agressivo que no passado lhe daria poucos meses de vida mas que agora está bem funcional.
Um exemplo marcante envolve o melanoma, a versão mais mortal do câncer de pele. “Atualmente, 50% dos pacientes estão vivos e alguns curados cinco anos depois do diagnóstico. Há dez anos, essa taxa era de 0%”, compara o oncologista Sergio Simon, médico do Grupo Oncoclínicas e do Hospital Israelita Albert Einstein, em São Paulo.
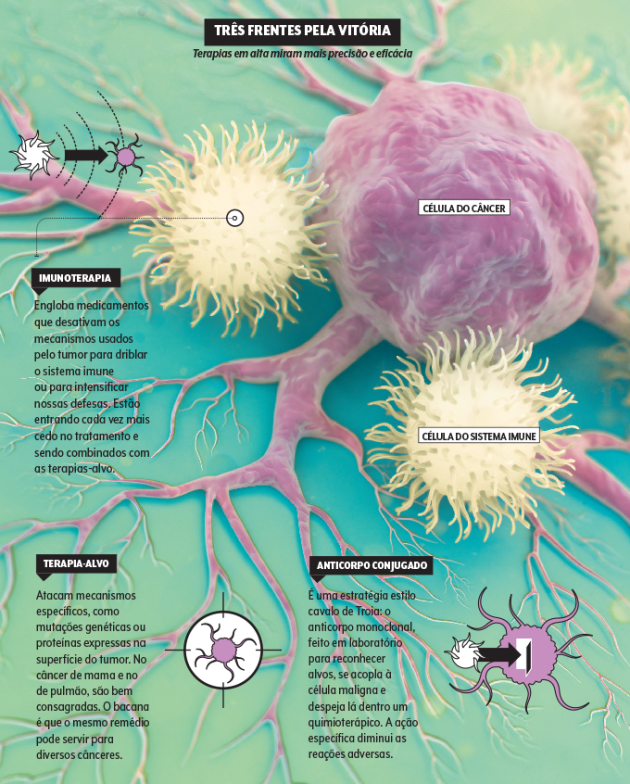
O que mudou o cenário nesse caso foi a imunoterapia, classe de drogas que ativam as defesas do próprio corpo contra a doença e são fruto do trabalho de cientistas agraciados com o Prêmio Nobel de Medicina em 2018. “Agora sabemos que o sistema imune é capaz de destruir o câncer, e só não o faz porque ele dá um jeito de escapar do hospedeiro”, destrincha Simon, que tem quatro décadas de oncologia no currículo.
O tumor não é um ser vivo independente, mas tem um funcionamento de dar inveja a muitas células e micróbios. Dá seus pulos para se disfarçar, tapear o organismo e crescer impune por meio de mecanismos distintos, que podem mudar com o passar do tempo.
“Depois de entendermos que mutações genéticas herdadas ou adquiridas levam ao câncer, a nova revolução está sendo conhecer os aspectos moleculares e a heterogeneidade das células tumorais, o que permite desenvolver medicamentos com alvos específicos para bloquear esses mecanismos de escape e, no futuro, combinar as terapias”, contextualiza o oncologista Paulo Hoff, presidente da Oncologia D’Or.
O otimismo com os avanços é tamanho que, nos Estados Unidos, o presidente Joe Biden anunciou a meta de reduzir o número de mortes por câncer pela metade nos próximos 25 anos.

Enquanto isso, no Brasil, os profissionais da área, empolgados com as perspectivas, também se lamentam pelas dificuldades e desigualdades no acesso aos tratamentos de ponta e pela demora que as novidades levam para chegar aos pacientes.
A boa notícia é que já temos soluções sendo apresentadas nesse sentido.
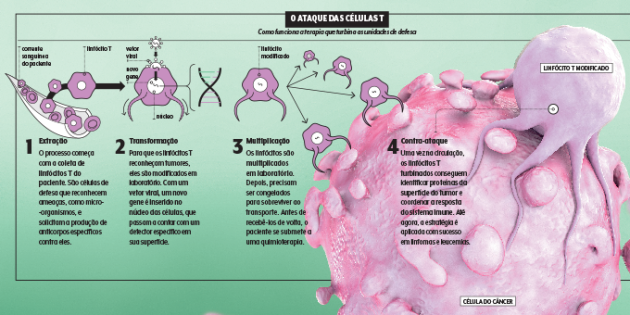
Em 2019, o servidor público aposentado Vamberto Luiz de Castro, de Ribeirão Preto (SP), virou celebridade ao se tornar o primeiro brasileiro curado de um linfoma não Hodgkin com a terapia CAR-T. A estratégia, que modifica células de defesa do próprio indivíduo para que elas reconheçam e ataquem as unidades malignas, está mudando o jeito de tratar linfomas e leucemias.
Revisões robustas de estudos clínicos com esse tratamento evidenciam que a taxa de resposta e melhora beira os 80%. Neste ano, as primeiras terapias CAR-T, trazidas pelas farmacêuticas Novartis e Janssen, foram aprovadas para uso no Brasil. Após o aval da Agência Nacional de Vigilância Sanitária, a Anvisa, elas ainda precisam ser precificadas, mas se espera que o valor ultrapasse 1 milhão de reais.
Bem, aí começa o dilema do acesso, tanto no setor público como no privado. Uma maneira de viabilizar a prescrição em maior escala é dispor de uma versão 100% nacional da terapia, como a que curou o senhor Castro. E, sim, nós já temos um CAR-T brasileiro, desenvolvido pela Universidade de São Paulo (USP), em Ribeirão Preto.
A técnica, até então estudada de modo experimental no interior paulista, deve ganhar corpo e um maior grupo de beneficiários por meio de uma parceria recém-anunciada entre a USP e o Instituto Butantan. “Estamos entrando com a nossa experiência e capacidade fabril, e esperamos uma produção na ordem de 300 tratamentos ao ano, que é equivalente ao que se produz hoje nas grandes companhias”, explica o médico Dimas Covas, presidente do Butantan.
As fábricas já estão construídas e passarão por uma avaliação da Anvisa para que as pesquisas clínicas pré-aprovação iniciem. A fabricação made in Brazil tem tudo para derrubar o custo. “Imaginamos algo entre 10 e 20% do valor que é praticado hoje”, aponta o hematologista Rodrigo Calado, diretor do Hemocentro da USP de Ribeirão Preto e coordenador dos estudos.
Covas, que também é hematologista e participa da evolução das terapias celulares, fala das CAR-T com entusiasmo e potencial de expansão. “O que se projeta é que tenhamos produtos similares disponíveis na prateleira em dez ou 15 anos”, conta.
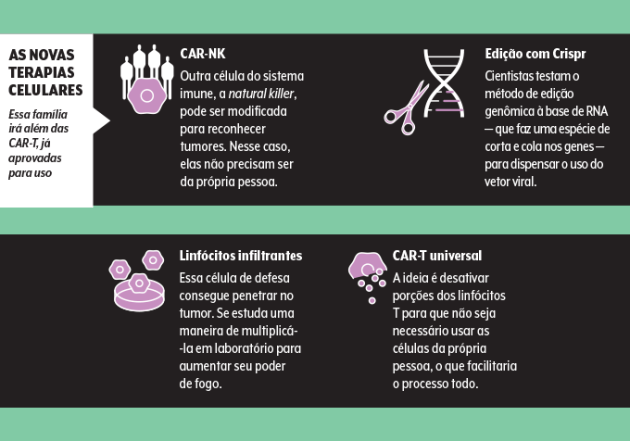
Por ‘na prateleira’ ele quer dizer criar células turbinadas universais, que possam ser usadas em qualquer paciente — hoje o tratamento é absolutamente individualizado. É mais difícil fazer isso com os linfócitos T, alvo da CAR-T, mas outras células do sistema imune são mais flexíveis, como as NK, ou natural killers (algo como “assassinas naturais”), e já estão na mira dos cientistas.
As terapias celulares, encabeçadas pela CAR-T, mal chegaram e já passam por aperfeiçoamentos. “Estão em testes medicamentos ‘CAR’ que identificam dois ou três alvos diferentes [hoje se mira uma proteína do tumor, a CD 19] e temos 16 terapias em fase de desenvolvimento somente na nossa empresa”, relata Lenio Alvarenga, diretor clínico da Novartis.
De olho nisso, a Associação Brasileira de Hematologia, Hemoterapia e Terapia Celular (ABHH) lançou em 2021 seu primeiro consenso sobre o assunto. “O documento reforça que o Brasil está atento às tendências mundiais e pronto para aplicar esse tipo de tratamento”, destaca o hematologista Renato Cunha, da ABHH, que participou da elaboração da diretris.
Em busca do(s) alvo(s) perfeito(s)
No imaginário popular, um tumor é quase um caroço. Proponho dar um zoom nessa imagem. Em vez de um nódulo, pense em um aglomerado de centenas de milhares de células, cada qual com seu código genético, modificado para elas crescerem descontroladamente e se infiltrar nos tecidos do corpo, usando hormônios ou oxigênio para se “alimentar” e vestindo moléculas que lhes dão um dom de camuflagem.
Esse ecossistema, que ainda envolve substâncias produzidas ou recrutadas pelas células malignas, é conhecido como microambiente tumoral e comandado por mutações genéticas, herdadas ou adquiridas. Daí vem a reclassificação dos tumores em subclasses, um processo em construção contínua.
Hoje se olha cada vez menos para o órgão de origem do câncer e mais para suas características moleculares. “Se dermos sorte, achamos uma mutação capaz de definir melhor o tratamento”, diz o oncologista Stephen Stefani, do Grupo Oncoclínicas.
A imunoterapia é uma das abordagens mais ancoradas nesse raciocínio. “Só 50% dos pacientes se beneficiam dela, mas, ao entendermos os motivos disso, estamos conseguindo ampliar esse número”, elucida Christine Roth, chefe da Unidade de Negócios de Oncologia da Bayer.
Para dar um exemplo do grau de precisão, e da diferença que isso faz, vejamos o caso de uma mutação bem rara, a da instabilidade de microssatélite, que atinge menos de 5% dos portadores de câncer colorretal. “Estudos recentes mostram que, nesse grupo, a imunoterapia consegue, sozinha, promover respostas quase completas”, conta o oncologista Fernando Maluf, diretor de Oncologia da BP — A Beneficência Portuguesa de São Paulo.
Com o mergulho nas características moleculares do câncer, foi possível descobrir que suas células também são diferentes entre si.
Ou seja: você mata a célula com a característica X, mas daí uma com a alteração Y se aproveita para crescer sem competição. Se esse fenômeno complica a vida por um lado, por outro indica caminhos, como combinar tratamentos pensando em alterações moleculares diferentes e monitorar as pessoas com essas características para se antecipar às chamadas recidivas — quando a doença reaparece.
Nesse contexto, também ganha força a ideia de conceber remédios com ação ultraprecisa e com melhor controle das suas repercussões nos arredores do tumor. É o caso de uma nova categoria terapêutica, a dos anticorpos conjugados a droga.
O anticorpo monoclonal é feito em laboratório, programado para detectar proteínas, os antígenos, que ficam na superfície do tumor. É um esquema chave-fechadura: ele se liga à célula por meio dessa proteína. No caso do anticorpo conjugado, ele carrega junto um quimioterápico fortíssimo, que é despejado dentro das células tumorais.
Um desses medicamentos, o trastuzumabe-deruxtecan, mira a HER2, proteína expressa por certos tumores de mama e de outros órgãos, e tem se saído muito bem nos estudos.
Neste ano, pesquisadores descobriram que mesmo mulheres com baixos níveis de HER2 e em estágio avançado da doença podem se beneficiar da medicação. “Graças a uma tecnologia que aumenta a capacidade de carga do anticorpo, conseguimos inserir mais quimioterápicos dentro do tumor e observamos um efeito nas células do entorno, que parece melhorar a resposta clínica”, detalha Allyson Nakamoto, diretor da Unidade de Negócios de Oncologia da Daiichi-Sankyo, fabricante do trastuzumabe-deruxtecan, já aprovado no Brasil.
No último congresso da Sociedade Europeia de Oncologia (Esmo), o remédio foi destaque ao lado de outro anticorpo conjugado, o sacituzumabe govitecan, que dobrou o tempo de sobrevida de mulheres com câncer de mama triplo negativo metastático, de seis para 12 meses. Parece pouco, mas faz diferença em um cenário crítico como esse. “São avanços muito importantes para mulheres que praticamente não tinham opções de tratamento”, diz a oncologista Laura Testa, da Rede D’Or.
Recentemente, o medicamento foi aprovado pela Anvisa para o tratamento desse tipo de câncer, em seu estágio mais avançado, para mulheres que receberam duas ou mais terapias sistêmicas anteriores.
Anticorpos conjugados a droga, imunoterapia, terapias-alvo, CAR-T… Praticamente todas as inovações na oncologia só existem devido a outra revolução, a da genômica.
Fora vasculhar o DNA do paciente e do tumor por meio de exames, ela vem permitindo modificar o código genético das células para aprimorar o tratamento. Tem gente com medo de tomar a vacina da Covid-19 por ela ser feita com RNA mensageiro, mas a tendência é que terapias originárias de tecnologias semelhantes se tornem uma realidade nos próximos anos — especialmente contra o câncer.
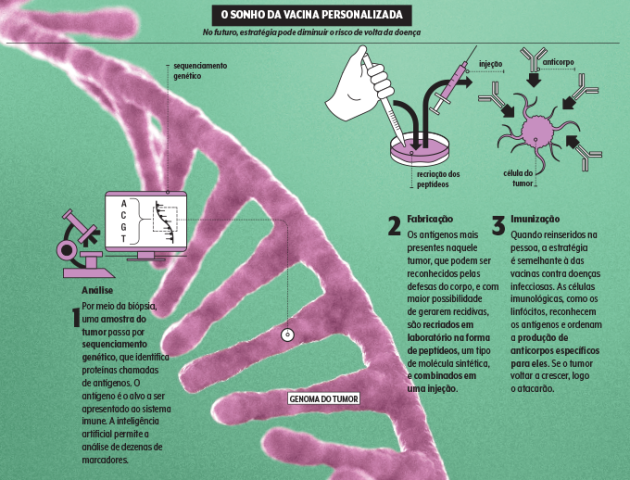
No horizonte, podemos prever até vacinas terapêuticas, contendo um RNA que ordene a produção de partículas inofensivas de um tumor para que nosso sistema imune aprenda a reconhecê-lo e atacá-lo quando a doença real surgir. A USP tem trabalhos com essa plataforma e já obteve resultados positivos em testes com animais.
Outra possibilidade seria a criação de vacinas personalizadas, algo já em avaliação na Clínica Mayo, nos Estados Unidos. “Com a ajuda de algoritmos, mapeamos os genes de um tumor, simulamos suas interações com o sistema imune e montamos uma vacina com os elementos mais relevantes para aquele paciente em específico”, afirma Keith Knutson, colíder do Programa de Imunologia e Imunoterapia da Mayo.
Seria possível incluir dezenas de alvos, até aqueles presentes em menor quantidade, mas com potencial para se tornarem os bois superpopulosos do exemplo de Hoff.
A ideia é evitar a volta da doença ao enviar lembretes constantes do inimigo para a imunidade. E, no departamento dos genes, ainda tem coisa que parece filme de ficção científica, como uma estratégia da Sanofi que adiciona duas “letras” a mais no DNA em laboratório para produzir proteínas habilitadas a combater os tumores sem prejudicar os tecidos saudáveis.
O trabalho do oncologista está ficando mais complexo e colaborativo. “Com o aprofundamento do conhecimento, você depende de outras áreas para oferecer um cuidado completo”, comenta Maluf.
Nesse sentido, é fundamental falar de avanços que vão além dos medicamentos, como a ascensão dos enfermeiros navegadores, que capitaneiam a jornada do paciente no confuso mar de exames, procedimentos e tratamentos.
Outro ponto a comemorar é o aprimoramento das intervenções mais clássicas, que ainda têm (e terão por um bom tempo) um papel a cumprir, como a quimio e a radioterapia. No caso da químio, já temos exames para determinar se o indivíduo responderá ou não a ela.
Já a radioterapia está mais high-tech, guiada em tempo real por aparelhos de imagem e com uma precisão que evita danos adjacentes. Lembrando que, dada a individualidade do tumor, nem sempre o que funciona para uma pessoa funciona para outra. Convém ter isso em mente ao ler ou escutar promessas contra o câncer.
Por fim, precisamos discutir o elefante na sala. “O efeito colateral dessa nova era terapêutica é que a maioria das drogas é caríssima e poucas estão disponíveis no Sistema Único de Saúde, o SUS”, aponta Stefani.
É o que os especialistas chamam de toxicidade financeira: o remédio em si é bem-vindo ao corpo do paciente, mas o estrago feito na vida da pessoa para custeá-lo é considerável. Entre as terapias mencionadas nesta reportagem, é comum encontrar custos de dezenas de milhares de reais por mês. “Esse é um dos grandes impeditivos hoje para reduzirmos a mortalidade por câncer”, ressalta Simon.
No caso dos anticorpos conjugados a droga, cada infusão, a ser tomada em intervalos de 21 dias, custa cerca de 60 mil reais. É o preço de um carro, que muita gente não pode pagar e nem sempre o convênio ou o SUS cobrirão. “Estudos calculam que 40% do gasto mundial em tratamentos oncológicos sai do bolso do paciente, e isso pode levar a perda de bens, empobrecimento das famílias, não adesão à terapia e judicialização da saúde”, afirma o oncologista Felipe Roitberg, brasileiro que faz parte do comitê organizador de oncologia global da Esmo.
As indústrias farmacêuticas ouvidas por VEJA SAÚDE afirmam que trabalham junto com os governos para discutir modelos de remuneração e viabilizar o acesso. Algumas disseram também que seus departamentos dedicados à causa cresceram e contam com mais profissionais procurando solucionar essa equação.
Mas estudiosos e ativistas ainda questionam uma possível falta de transparência em relação ao investimento real de pesquisa e desenvolvimento das medicações, argumento usado para justificar os preços elevados. Realmente, não é barato fazer uma nova molécula sair do laboratório.
Porém, acumulam-se evidências, nos periódicos médicos, de que o repasse ao paciente e à sociedade não deveria ser tão caro. Um estudo recém-publicado no Journal of the American Medical Association (JAMA) por uma equipe ligada à Organização Mundial da Saúde (OMS) e à London School of Economics and Political Science, na Inglaterra, analisou mais de 60 drogas lançadas entre 2009 e 2018 e concluiu que o alto custo não pode necessariamente ser justificado pelos gastos com pesquisas.
Para piorar, não é só sobre a precificação que pairam incertezas, mas também sobre os próprios benefícios de alguns remédios. Outra investigação, apresentada no encontro da Esmo, avaliou cinco anos de aprovações de tratamentos contra tumores sólidos pelo governo dos EUA.
Pasme com o resultado: menos de 30% das drogas liberadas conferiam benefício substancial ao paciente, como um bom tempo de sobrevida ou livre da progressão da doença. “Desfechos analisados em estudos clínicos precisam ser colocados em perspectiva de forma comparativa e consistente com os tratamentos existentes”, pontua Roitberg.
O que isso quer dizer na prática? É preciso rever a maneira como a eficácia dessas drogas é interpretada, considerando valor e benefício real para o paciente e o sistema de saúde. Já há escalas que buscam melhorar essa avaliação de impacto, como a que foi usada no estudo supramencionado.
Se o benefício for intermediário ou baixo e o custo muito alto, a priorização da droga poderia ser revista para alocar melhor recursos em outras searas, como acesso rápido a exames e tratamentos já consagrados. Só não dá pra pensar em desbravar fronteiras contra o câncer derrapando no básico, acentuando desigualdades e onerando famílias.
Precisamos pensar também em inovação política e social, tão importante quanto os progressos científicos. “Acesso não é só compra de medicamentos, mas todo um sistema de cuidado integrado, que contempla diagnóstico precoce, tratamento em tempo adequado e acompanhamento multidisciplinar. Tudo isso impacta o sucesso das terapias”, conclui Roitberg.
Em suma, o Brasil precisa se preparar melhor para essa revolução.

Fonte: Veja Saúde

